- 首页
- 产品中心
- EX1800 UHPLC/HPLC
- LC-100 HPLC
- LC-80 ChroMini
- EX2000 LC-MS
- GC280 / GCMS280
- 分析系统
- 氨基酸分析系统
- 制备/半制备系统
- GPC凝胶色谱系统
- 检测器单元
- 输液泵系列
- ARCUS自动进样器系列
- 工作站 EX-CLARITY
- 耗材零部件
- 新闻动态
- 应用支持
- 客户服务
应用支持
application examples
DLPME-HPLC同时测定微量人血清中的维生素A和E
发布时间:2020-08-20 / 浏览次数:2,648 次郑凤家1别明江2孙成均1*
1.四川大学华西公共卫生学院,成都610041;
2.四川大学华西第四附属医院检验科,成都,610041
摘要:[目的]建立了人血清中维生素A和E的分散液相微萃取(dispersive liquid phase microextraction,DLPME)-高效液相色谱分析方法。[方法]取血清20μl,加入50μl甲醇,漩涡震荡10s后加50μl三氯甲烷超声萃取,高速离心后吸取下层三氯甲烷层供高效液相色谱分析,标准曲线法定量。色谱分析条件为:色谱柱为Eclipse XDB – C8(150 mm × 4.6 mm,5μm);流动相为甲醇-水(96+4);流速为0.80 ml/min;柱温为25℃;紫外检测波长:维生素A为325nm,维生素E为292nm。[结果]维生素A和E标准曲线的相关系数均大于0.999;相对标准偏差均小于5%。对于20μl血清,本法的检出限维生素A为0.035μg∕ml;维生素E为0.09μg∕ml。维生素A和E的加标回收率分别为90.4%~103.2%和81.0%~92.1%。[结论]本法灵敏、准确、快速、简便,节约有机溶剂,适合于血清中维生素A和E的快速测定,是环境友好型的绿色分析方法。
关键词:分散液相微萃取;维生素A;维生素E;高效液相色谱;血清
Simultaneous determination of vitamin A and E in microamount of human serum by dispersive liquid phase micro-extraction – high performance liquid chromatography
ZHENG Fengjia, BIE Mingjiang, SUN Chengjun*
West China School of Public Health, Sichuan University, Chengdu 610041, China
Abstract:[Objective]To establish a dispersive liquid phase microextraction–high performance liquid chromatography for simultaneous determination of vitamin A and E in microamout of human serum.[Method]Twenty microliter of human serum was taken and 50μl methanol added to precipitate the protein, and 50μl chloroform added to extract vitamin A and E ultrasonically. After centrifuged at 12000rpm for 5 min, the lower chloroform layer was taken and injected for HPLC analysis. The optimized chromatographic conditions were as follows: analytical column: (Eclipse XDB-C8, 150 mm × 4.6 mm,5μm); mobile phase: methanol-water (96+4); flow rate: 0.80 ml/min; column temperature: 25℃; detection wavelength: 325nm for vitamin A and 292nm for vitamin E, respectively.[Results]The correlation coefficients for the standard curves were greater than 0.999 for both vitamin A and E; the detection limits of the method were 0.035μg ∕ ml for vitamin A and 0.09μg ∕ ml for vitamin E. The recoveries of vitamin A and E in human serum ranged from 90.4%~103.2% and 81.0%~92.1%, respectively.[Conclusion]The method is sensitive, accurate, rapid, simple, and suitable for the determination of vitamins A and E in microamount of human serum.
Key words :Dispersive liquid phase microextraction;Vitamin A;Vitamin E;Human Serum;High performance liquid chromatography
::__IHACKLOG_REMOTE_IMAGE_AUTODOWN_BLOCK__::0*通讯联系人:孙成均,教授。E-mail:sunchj2005@yahoo.com.cn
维生素A 和维生素E是维持机体正常生长的必需脂溶性维生素。目前,国内外测定血清[1]和全血[2]中维生素A和E的方法很多。这些方法中的前处理技术有液-液萃取[1]、固相萃取[3]、浊点萃取[4]等等。这些前处理技术有的繁琐耗时、需要较多有机溶剂,且血清量需要量较大。整个样品分析过程中,前处理过程所需的时间占整个分析时间的2/3,并可能产生1/3以上的误差[5]。分散液相微萃取(dispersive liquid phase micoextraction, DLPME)技术首先见于Rezaee等[6-7]的报道,该法集萃取和浓缩于一体,是一种操作简单、快速、成本低且对环境友好的样品前处理新技术。现在分散液相微萃取技术对生物样品和环境样品中的农药[8-10]、重金属[11-12]等的提取报道很多,但在血清中维生素A和E的测定中尚未见报道。
本文将该技术应用于萃取浓缩微量人血清中的维生素A和E,大大缩短了分析时间,减少了样品和有机溶剂的用量,降低了分析成本,为分析人微量血清中维生素A和E的含量提供了快速、简便、准确、灵敏的方法,在人群血清维生素A和E的快速检测中有很好的应用价值。
1. 实验部分
1.1.仪器与试剂高效液相色谱仪(EX1600,上海伍丰科学仪器有限公司),带紫外检测器(EX1600UV);C8柱(Eclipse XDB-C8,4.6 mm × 15 cm,5.0μm),同类型保护柱;WH-1微型漩涡混合仪;台式高速离心机(Anke TGL-16B);超声波清洗器(KQ-250型)。维生素A(视黄醇)标准品(FLUKA,>99%);维生素E标准品(Sigma,>95%);三氯甲烷(色谱纯);甲醇(色谱纯);维生素A标准储备液(1mg/ml):甲醇配制,于-20℃冰箱冷藏保存;维生素E标准储备液(2mg/ml):甲醇配制,于-20℃冰箱冷藏保存;维生素A和E混合标准应用液(VA 1μg/ml,VE 5μg/ml):测定前,按文献[13]方法对维生素A和维生素E标准储备液浓度进行标定,再以其实际浓度用甲醇稀释成混合液。实验用水为Millipore超纯水(18.2 MΩ·cm)。
1.2实验方法
1.2.1色谱条件流动相为甲醇-水(96+4),超声波脱气后使用;流速:0.8 ml/min;柱温:25℃;波长切换程序:0~5.0min,325 nm,5.0~10min,292 nm。
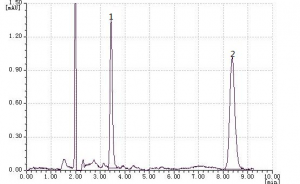
1.2.2标准曲线的绘制在高效液相色谱仪基线达平直后,分别进样VA 和VE 混合标准应用液 2.00、5.00、10.0、20.0μl(相当于VA 2, 5,10,20ng, VE 10,25,50,100 ng),以保留时间定性,记录各自峰面积。分别以VA和VE含量(ng) 对峰面积线性回归。维生素A和E标准色谱图见图1。
Fig 1 The chromatogram of vitamins A and E standard solution
1.维生素A(Vitamin A,3.8min) 2.维生素E(Vitamin E,8.4min)
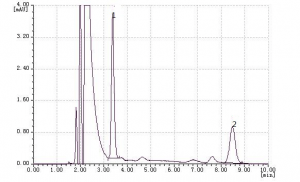
1.2.3 样品处理与测定取新鲜人血清20μl于200μl EP管中,加入50μl甲醇漩涡混匀10s,然后加入50μl三氯甲烷,超声萃取3min后,以12000 r/min离心5min。用微量进样针伸入EP管底部取10μl萃取液进样分析,样品图谱见图2。
1.2.4 结果计算 根据样品图谱维生素A和E的峰面积,通过回归方程计算进样液中维生素A和E的含量(ng),按下式计算血清中维生素A和E的浓度(μg /ml)。

式中:::__IHACKLOG_REMOTE_IMAGE_AUTODOWN_BLOCK__::3为维生素A和E的浓度(μg/ml),::__IHACKLOG_REMOTE_IMAGE_AUTODOWN_BLOCK__::4为由回归方程计算的进样液中维生素A或E的含量(ng)。
图2样品萃取后维生素A和E的色谱图
Fig 2 The chromatogram of a human serum sample
1.维生素A(Vitamin A,3.8min) 2.维生素E(Vitamin E,8.4min)
2结果与讨论
2.1液相微萃取条件的优化
2.1.1 液相萃取剂的选择 实验选取了三氯甲烷、二氯甲烷、正己烷3种有机溶剂进行萃取条件试验。试验结果表明,在相同条件下,三氯甲烷的萃取效率及其稳定性要高于二氯甲烷和正己烷,二氯甲烷尽管萃取效率高,但易挥发,结果不稳定,故本法选三氯甲烷作为液相微萃取剂。
2.1.2 三氯甲烷萃取剂体积的选择 实验选择了20μl、40μl、50μl在相同条件下萃取样品,当萃取剂体积为20和40μl时,萃取效率偏低,且不稳定,当萃取剂量达到50μl时,萃取效率达到分析要求,且实验结果稳定性好,因此选择三氯甲烷萃取剂的体积为50μl。
2.1.3 超声萃取时间的选择分散液相微萃取是一个样品的富集平衡过程,需要一定的时间。实验研究了1min、3min、5min这三个时间点的超声萃取效果,3min时效果最佳,而1min时萃取效率过低,这可能与超声时间过短,尚未达到富集平衡有关。5min时实验结果不稳定,这可能和超声时间过长,萃取剂挥发损失以及维生素A和E部分分解有关。所以,本法选择超声萃取时间为3min。
2.2 方法性能指标
2.2.1标准曲线和工作曲线本法实验条件下,维生素A和E的线性范围远大于实验范围,考虑到本法主要用于微量血清中维生素A和E的测定,故未测定线性范围上限。在本实验线性范围内,维生素A的标准曲线方程为:A=677.8m +23.95,相关系数r=0.9991;维生素E的标准曲线方程为:A=32.85m+70.5,相关系数r=0.9999。为了检验分散液相微萃取过程对标准系列的影响,在样品微萃取条件下对标准系列进行处理后再测定,结果所得维生素A的工作曲线方程为:A = 605.31m +18.85,相关系数r=0.9990;维生素E的工作曲线方程为:A = 35.96 m+60.8 ,相关系数r=0.9990.分别对维生素A和E的标准曲线和工作曲线的斜率进行t检验,得p>0.05,即标准曲线和工作曲线的斜率无显著性差异,所以本法采用标准曲线法来计算样品中的维生素A和E的含量。
2.2.2 方法的检出限 以仪器基线的3倍噪声所对应的待测物在进样液的浓度为方法的检出限,以20μl血清,最终稀释至50μl,取10μl进样,计算出样品中维生素A和E的最低检出浓度为0.035μg∕ml和0.09μg∕ml。完全可满足实际样品测定的要求。
2.2.3 方法的精密度取6份同一血清,各20μl,按样品处理方法提取和测定,计算方法的精密度(表1)。由表1可见,本法维生素A和E测定值的相对标准偏差分别为7.78%和5.43%。
表1 方法精密度实验结果(n=6)
维生素 含量范围(ng) 均值(ng) SD(ng) RSD(%) Vitamin A 1.84~2.11 1.93 0.15 7.78 Vitamin E 21.0~23.1 21.91 1.19 5.43 2.2.4 方法准确度实验 在3份相同样品中,分别加入不同量的标准溶液,再按本法处理和测定,根据加标前后测定值计算加标回收率,实验结果见表2。由表2可见,本法维生素A和E的加标回收率分别为90.4%~103.2%(平均为94.9%)和81.0%~92.1%(平均为86.6%)。
表2 方法加标回收率
维生素 背景值(ng) 加标量(ng) 测定值(ng) 回收率(%) 0.63 2.37 90.4 Vitamin A 1.80 1.26 3.10 103.2 2.52 4.10 91.2 8.77 28.1 81.0 Vitamin E 21.0 21.9 40.0 86.8 43.8 61.3 92.1 2.2.5样品测定用本法测定了15名健康成人的血清,所测维生素A的含量范围为(0.56±0.05)μg/ml。维生素E的含量范围为(8.46±0.57)μg/ml,与相关文献的报道值一致。
3 结论本文建立了分散液相微萃取-高效液相色谱法分析维生素A和E的方法,该法操作简便,大大缩短了分析时间,节约了试剂,是环境友好型的分析方法,在维生素A和E的快速检验中有着很好的推广应用价值。
参考文献
[1]徐军,张慧芬,邵裕坤,等.高效液相色谱法测定人血中脂溶性维生素的含量[J].中国药学杂志,2006,41(2):147-149
[2]胡艳,王希希,孙成均. 高效液相色谱法同时测定微量全血中维生素A 和E[J].现代预防医学,2009,36(1):120-122
[3]Chatzimichalakis P F,Samanidou V F,Papadoyannis I N. Journal of Chromatography B,2004,805(2):289-296
[4]Sirimanne S R, Patterson D G, Ma L, et al. Journal of Chromatography B: Biomedical Sciences and Applications,1998,716(1-2):129-137
[5]李攻科,胡玉玲,阮贵华.样品前处理仪器与装置[M].北京:化学工业出版社,2007
[6]Rezaee M, Assadi Y, Milani Hosseini M R, et al. Chromatography A, 2006, 1116(1-2): 1
[7]Li H, Lee H K. Journal of Chromatography A,2002,976(1~2):377
[8]Berijani S, Assadi Y, Anbia M,et al. Journal of Chromatography A, 2006, 1123(1):1-9
[9]Nagaraju D,Huang S D. Journal of chromatography A,2007,1161(1~2):89-97
[10]Zhou Q X, Bai H H, Xie G H,etc. Journal of Chromatography A, 2008, 1177(1):43-49
[11]Jiang H M, Qin Y C, Hu B. Talanta,2008,74(5):1160-1165
[12]Farajzadeh M A, Bahram M, Mehr B G, et al. Talanta,2008,75(3):832-840
[13]GB/T5009.82-2003. 食品中维生素A 和维生素E的测定